Il carcinoma prostatico localmente avanzato (LAPC) comprende circa il 15% di tutte le diagnosi di tumore della prostata. Nonostante i trattamenti radicali – come la prostatectomia o la radioterapia combinata con terapia ormonale – molti pazienti presentano ricadute locali o a distanza.
Le attuali classificazioni clinico-patologiche non sono sufficienti a prevedere con precisione la progressione metastatica.
Recentemente, l’analisi del DNA tumorale circolante (ctDNA) ha mostrato potenzialità nel predire la risposta terapeutica e l’evoluzione della malattia in vari tipi di tumore. Tuttavia, il suo ruolo nel LAPC non era ancora stato studiato in modo sistematico.
L’obiettivo di questo lavoro è stato quindi esplorare l’utilità del ctDNA come biomarcatore prognostico per individuare precocemente i pazienti a più alto rischio di metastasi.
Sono stati arruolati 40 pazienti con diagnosi istologica di adenocarcinoma prostatico localmente avanzato.
Tutti sono stati sottoposti a prostatectomia radicale, con o senza dissezione linfonodale, tra settembre 2021 e febbraio 2024.
I campioni di tessuto prostatico e plasmatico sono stati raccolti prima dell’inizio del trattamento.
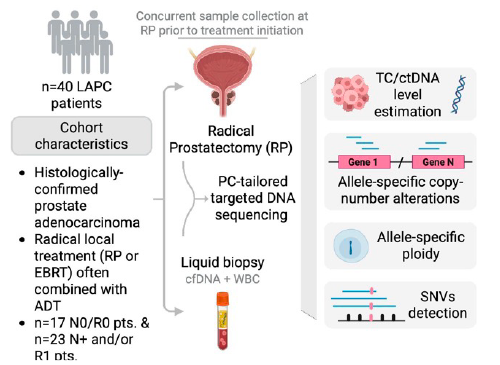
Il sequenziamento del DNA è stato effettuato utilizzando il pannello genico di PCF_SELECT, specifico per rilevare le alterazioni geniche del carcinoma prostatico.
Le analisi hanno incluso:
- Quantificazione del contenuto tumorale (TC) nei tessuti e del ctDNA nel plasma;
- Stima della ploidia allele-specifica;
- Identificazione di varianti puntiformi e alterazioni del numero di copie geniche.
I dati molecolari sono stati poi correlati con gli esiti clinici, tra cui recidiva biochimica, metastasi e sopravvivenza libera da progressione.
Il segnale tumorale è stato rilevato nel 92,5% dei campioni tissutali, con un contenuto tumorale medio del 39%.
Il ctDNA era presente nel 40% dei pazienti al basale.
Le aberrazioni genetiche più comuni hanno interessato i geni NKX3-1, PTEN, CHD1, TP53 e MYC, noti per il loro ruolo nel controllo della crescita e della differenziazione cellulare prostatica.

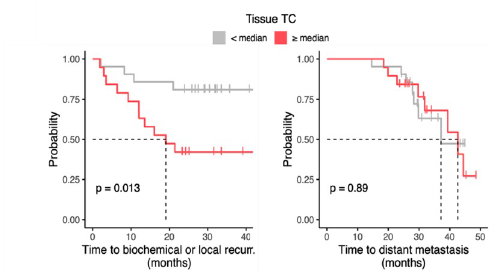
Un’elevata quota di DNA tumorale nel tessutosi è associata a un maggior rischio di recidiva locale e di coinvolgimento linfonodale, ma non di metastasi a distanza.
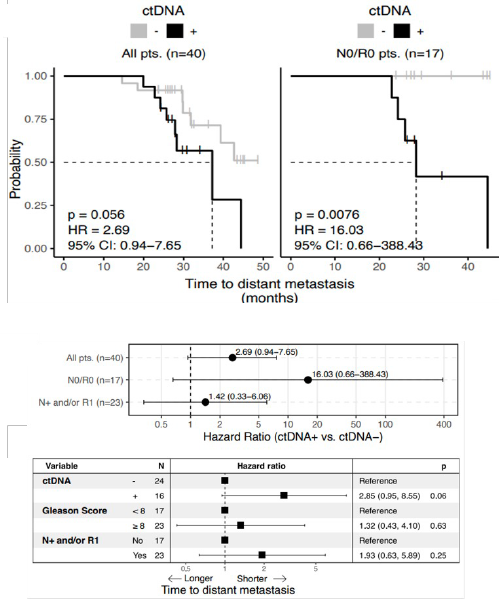
La positività del ctDNA è risultata associata a una minore sopravvivenza libera da metastasi, specialmente nei pazienti con linfonodi negativi (N0) e margini chirurgici puliti (R0).
L’analisi multivariata ha confermato che la presenza di ctDNA rappresenta il principale fattore prognostico indipendente per lo sviluppo metastatico (Figura 4).
Inoltre, l’analisi di specifiche alterazioni qualitative ha mostrato che la presenza di mutazioni di TP53 nel tessuto e varianti di MYC nel DNA tumorale circolante si sono rivelate indicatori significativi di progressione metastatica.

Questo studio è il primo a integrare in modo prospettico l’analisi simultanea di tessuto prostatico e DNA plasmatico in pazienti con LAPC.
I risultati dimostrano che il ctDNA può fungere da indicatore precoce di progressione metastatica, fornendo informazioni complementari a quelle ottenute dai parametri clinico-patologici tradizionali.
Le alterazioni genetiche osservate (in particolare in TP53 e MYC) riflettono una maggiore instabilità genomica e una più alta aggressività tumorale.
Queste osservazioni sottolineano il valore della biopsia liquida come strumento non invasivo per monitorare la malattia residua e ottimizzare la gestione terapeutica postoperatoria.
Nonostante le limitazioni dovute alla dimensione ridotta del campione, lo studio apre la strada a ulteriori ricerche multicentriche per validare l’uso del ctDNA nella pratica clinica.
Finanziamento dello studio
Lo studio è stato parzialmente finanziato da Bayer.

